由于格式問題此試題可能會出現(xiàn)亂碼的情況
為了方便您閱讀請點(diǎn)擊右上角的全屏查看
2018眉山市中考化學(xué)壓軸試題
一、選擇題
1.下列化學(xué)反應(yīng)屬于置換反應(yīng)的是( )
A.CO+CuO![]() Cu+CO2????????????? B.Cl2+H2O=HCl+HClO
Cu+CO2????????????? B.Cl2+H2O=HCl+HClO
C.Na2O+HCl=2NaCl+H2O????????????? D.C+H2O![]() H2+CO
H2+CO
2.下列做法可以達(dá)到預(yù)期目的是( )
A.用氖氣作焊接金屬的保護(hù)氣
B.加入凈水劑(如明礬),使硬水轉(zhuǎn)化成純凈水
C.尋找新的催化劑使水變成油
D.做測定空氣中氧氣含量的實(shí)驗(yàn)時(shí),用蠟燭代替紅磷
3.硝化甘油(C3H5N3O9)可用于治療心絞痛,因?yàn)樗谌梭w內(nèi)被緩慢氧化生成A氣體:4C3H5N3O9+5O2═12A+12CO2+10H2O,則A的化學(xué)式為( )
A.NO????????????? B.NO2????????????? C.N2????????????? D.N2O
4.下列化常用語中,正確的是( )
A.兩個氧分子﹣O2
B.氫氧化鐵的化學(xué)式﹣Fe(OH)3
C.CO2中氧元素的化合價(jià)為+2價(jià)
D.水通電得到氧氣的化學(xué)方程式是2H2O=O2↑+2H2↑
5(眉山市中考化學(xué)).實(shí)驗(yàn)室用草酸(H2C2O4)制取CO的化學(xué)方程式為H2C2O4![]() CO↑+X+CO2↑其中X的化學(xué)式為( )
CO↑+X+CO2↑其中X的化學(xué)式為( )
A.H2O2????????????? B.H2O????????????? C.CH4????????????? D.H2
6.某有機(jī)物R在足量氧氣中完全燃燒后的化學(xué)方程式如下:2R+13O2![]() 8CO2+10H2O.根據(jù)質(zhì)量守定律,R的化學(xué)式為( )
8CO2+10H2O.根據(jù)質(zhì)量守定律,R的化學(xué)式為( )
A.C4H10????????????? B.CH4????????????? C.CH4O????????????? D.C2H4O2
7.如圖是用來表示物質(zhì)間發(fā)生化學(xué)變化的模型示意圖,圖中“![]() ”、“
”、“![]() ”分別表示兩種不同元素的原子.能用該示意圖表示的反應(yīng)是( )
”分別表示兩種不同元素的原子.能用該示意圖表示的反應(yīng)是( )
![]()
A.2H2+O2![]() 2H2O????????????? B.2H2O
2H2O????????????? B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2CO+O2![]() 2CO2????????????? D.H2+Cl2
2CO2????????????? D.H2+Cl2![]() 2HCl
2HCl
8.小明從化學(xué)方程式4P+5O2![]() 2P2O5中總結(jié)的信息有:①參加反應(yīng)的物質(zhì)是磷和氧氣②反應(yīng)條件是點(diǎn)燃③反應(yīng)前后分子的總數(shù)不變④反應(yīng)前后元素的種類不變.其中正確的是( )
2P2O5中總結(jié)的信息有:①參加反應(yīng)的物質(zhì)是磷和氧氣②反應(yīng)條件是點(diǎn)燃③反應(yīng)前后分子的總數(shù)不變④反應(yīng)前后元素的種類不變.其中正確的是( )
A.①②③????????????? B.①②④????????????? C.①③④????????????? D.②③④
9.在一只密閉容器內(nèi)有四種物質(zhì),在一定條件下充分反應(yīng),測得反應(yīng)前后各物質(zhì)的質(zhì)量如下表:
物質(zhì) | X | Y | Z | Q |
反應(yīng)前質(zhì)量/g | 8 | 2 | 40 | 5 |
反應(yīng)后質(zhì)量/g | 待測 | 24 | 8 | 23 |
下列說法正確的是( )
A.該反應(yīng)一定是置換反應(yīng)
B.Y、Q的相對分子質(zhì)量比一定為11:9
C.參加反應(yīng)的X、Z的質(zhì)量比為1:4
D.反應(yīng)后X的質(zhì)量為16
10.“綠色奧運(yùn)”是2008年北京奧運(yùn)會的主題之一.為減輕大氣污染,在汽車尾氣排放口加裝“三效催化凈化器”,在不消耗其他物質(zhì)的情況下,可將尾氣中的CO、NO轉(zhuǎn)化為參與大氣循環(huán)的無毒混合氣體.試推測,該無毒混合氣體是( )
A.N2和CO2????????????? B.C02和N02????????????? C.C02和O2????????????? D.CO2和SO2
11.(眉山市中考化學(xué))某化合物X在一定條件下有如下反應(yīng):X+6O2![]() 6CO2+6H2O.下列說法正確的( )
6CO2+6H2O.下列說法正確的( )
A.X由碳、氫兩種元素組成
B.X中碳、氫兩種元素的質(zhì)量比為1:2
C.X的相對分子質(zhì)量是174
D.X中碳元素的質(zhì)量分?jǐn)?shù)為40%
12.亞硝酸鈉(NaNO2)外觀與食鹽很相似,有咸味,誤食易中毒.區(qū)別它們的一種方法是:隔絕空氣加熱.沒有明顯變化的是食鹽.能分解放出有刺激性氣味氣體的是亞硝酸鈉.此氣體可能是( )
A.SO2????????????? B.NO2????????????? C.N2????????????? D.NH3
13.在一個密閉容器中,有甲、乙、丙、丁四種物質(zhì)在一定條件下充分反應(yīng),測得反應(yīng)前后各物質(zhì)質(zhì)量如下表,則該密閉容器中發(fā)生的化學(xué)反應(yīng)類型為( )
物質(zhì) | 甲 | 乙 | 丙 | 丁 |
反應(yīng)前質(zhì)量/g | 4 | 2 | 58 | 5 |
反應(yīng)后質(zhì)量/g | 待測 | 27 | 0 | 19 |
A.分解反應(yīng)????????????? B.化合反應(yīng)????????????? C.置換反應(yīng)????????????? D.復(fù)分解反應(yīng)
14.下列觀點(diǎn)中正確的是( )
A.通過化學(xué)變化可以改變原子的種類和個數(shù)
B.改變物質(zhì)的性質(zhì)一定要通過化學(xué)變化
C.在化學(xué)變化中原子中的電子數(shù)不會發(fā)生變化
D.在化學(xué)變化中都伴隨著能量的變化
二、填空
15.(2分)為了將汽油發(fā)動機(jī)尾氣中的NO轉(zhuǎn)化為N2,在某催化劑作用下用NH3與NO反應(yīng),其化學(xué)方程式為:4NH3+6NO![]() 5N2+6H2O;在通常狀況下,依據(jù)左式前后順序,反應(yīng)物與生成物中氣體的化學(xué)計(jì)量數(shù)之比= .
5N2+6H2O;在通常狀況下,依據(jù)左式前后順序,反應(yīng)物與生成物中氣體的化學(xué)計(jì)量數(shù)之比= .
16.(9分)完成下列反應(yīng)的化學(xué)方程式,在括號內(nèi)注明反應(yīng)類型(選填“化合”、“分解”、“置換”
或“復(fù)分解”)或回答問題.
(1)實(shí)驗(yàn)室加熱高錳酸鉀制氧氣的反應(yīng): 、 .
(2)實(shí)驗(yàn)室用鋅粒和稀硫酸制氫氣的反應(yīng): 、 .
(3)生石灰與水生成熟石灰的反應(yīng): ;此反應(yīng)過程中 (選填“吸熱”或“放出”)熱量.
(4)用澄清石灰水檢驗(yàn)二氧化碳的反應(yīng): ;
問:為何一般可用澄清石灰水檢驗(yàn)少量二氧化碳,卻用氫氧化鈉溶液吸收較多二氧化碳?
答: .
17.對知識的比較和歸納是學(xué)習(xí)科學(xué)的重要方法之一.現(xiàn)有以下3個反應(yīng)的化學(xué)方程式:
①CuSO4+Fe=Cu+FeSO4
②CuO+H2![]() Cu+H2O
Cu+H2O
③SiO2+2C![]() Si+2CO↑
Si+2CO↑
(1)比較反應(yīng)物和生成物的特點(diǎn),可歸納出這3個反應(yīng)的基本反應(yīng)類型都屬于 .
(2)從反應(yīng)條件角度分析,這3個反應(yīng)應(yīng)用于生產(chǎn)最早的是(填編號) .
18.自來水消毒過程中常會發(fā)生如下化學(xué)反應(yīng),其反應(yīng)的微觀過程可用如圖表示:
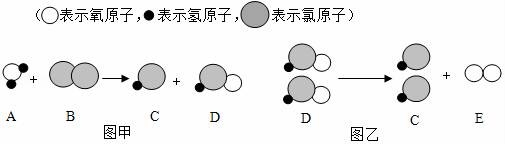
(1)圖乙所示反應(yīng)的基本反應(yīng)類型為 反應(yīng);
(2)D物質(zhì)中氯元素的化合價(jià)為 ;
(3)寫出圖甲所示反應(yīng)的化學(xué)方程式 .
四、計(jì)算題
19.工業(yè)上用電解氯化鎂方法生產(chǎn)金屬鎂:MgCl2![]() Mg+Cl2↑.現(xiàn)電解950Kg氯化鎂最多能生產(chǎn)多千克單質(zhì)鎂?同時(shí)能得到多少千克氯氣?
Mg+Cl2↑.現(xiàn)電解950Kg氯化鎂最多能生產(chǎn)多千克單質(zhì)鎂?同時(shí)能得到多少千克氯氣?
眉山市中考化學(xué)參考答案與試題解析
一、選擇題
1.下列化學(xué)反應(yīng)屬于置換反應(yīng)的是( )
A.CO+CuO![]() Cu+CO2????????????? B.Cl2+H2O=HCl+HClO
Cu+CO2????????????? B.Cl2+H2O=HCl+HClO
C.Na2O+HCl=2NaCl+H2O????????????? D.C+H2O![]() H2+CO
H2+CO
【考點(diǎn)】置換反應(yīng)及其應(yīng)用.
【分析】一種單質(zhì)與一種化合物發(fā)生反應(yīng)生成另一種單質(zhì)和另一種化合物的反應(yīng)是置換反應(yīng),其特征可表示為:A+BC=B+AC.
單質(zhì),由同種元素組成的純凈物;化合物,由不同種元素組成的純凈物.
【解答】解:A、CO、CuO均為兩種元素組成的化合物,反應(yīng)物中無單質(zhì),不符合置換反應(yīng)的定義.故不選.
B、生成物HCl、HClO均為化合物,生成物中無單質(zhì),不符合置換反應(yīng)的定義.故不選.
C、反應(yīng)物Na2O、HCl均為化合物,生成物NaCl、H2O也全是化合物,反應(yīng)中無單質(zhì),不符合置換反應(yīng)的定義.故不選.
D、反應(yīng)物中C只含C元素,為單質(zhì),H2O為化合物;生成物中H2為單質(zhì),CO為化合物,符合置換反應(yīng)的定義.故選.
故選D
【點(diǎn)評】明確物質(zhì)的分類,抓住概念的內(nèi)涵,對選項(xiàng)進(jìn)行分析.
2.(眉山市中考化學(xué))下列做法可以達(dá)到預(yù)期目的是( )
A.用氖氣作焊接金屬的保護(hù)氣
B.加入凈水劑(如明礬),使硬水轉(zhuǎn)化成純凈水
C.尋找新的催化劑使水變成油
D.做測定空氣中氧氣含量的實(shí)驗(yàn)時(shí),用蠟燭代替紅磷
【考點(diǎn)】常見氣體的用途;測定空氣里氧氣含量的探究;硬水與軟水;質(zhì)量守恒定律及其應(yīng)用.
【分析】A、根據(jù)氖氣的化學(xué)性質(zhì)不活潑判斷.
B、根據(jù)明礬的凈水原理,以及硬水的含義判斷.
C、根據(jù)質(zhì)量守恒定律判斷.
D、根據(jù)蠟燭燃燒的產(chǎn)物判斷.
【解答】解:A、氖氣的化學(xué)性質(zhì)不活潑,不和金屬反應(yīng),且可隔絕氧氣,防止金屬氧化,所以正確.
B、硬水是含有較多可溶的鈣、鎂化合物的水,明礬溶解于水形成膠狀物,能吸附水中不溶的雜質(zhì)沉降下來,不能吸附可溶的鈣、鎂化合物,不能把硬水變成純凈的水,所以錯誤.
C、根據(jù)質(zhì)量守恒定律,反應(yīng)前后元素的種類不變,水是由氫、氧兩種元素組成,油中含有碳元素,水永遠(yuǎn)不會變成油,所以錯誤.
D、做測定空氣中氧氣含量的實(shí)驗(yàn)時(shí),選擇的藥品應(yīng)是只能與氧氣反應(yīng),且反應(yīng)不生成新氣體,但是蠟燭燃燒生成二氧化碳?xì)怏w,所以錯誤.
故選A.
【點(diǎn)評】化學(xué)來源于生產(chǎn)、生活,也服務(wù)于生產(chǎn)、生活,因此與生產(chǎn)、生活相關(guān)的化學(xué)知識也是考查重點(diǎn),特別是關(guān)于食品安全、營養(yǎng)與健康、能源、材料、環(huán)境保護(hù)、中毒解毒知識、燃燒與滅火等內(nèi)容.
3.硝化甘油(C3H5N3O9)可用于治療心絞痛,因?yàn)樗谌梭w內(nèi)被緩慢氧化生成A氣體:4C3H5N3O9+5O2═12A+12CO2+10H2O,則A的化學(xué)式為( )
A.NO????????????? B.NO2????????????? C.N2????????????? D.N2O
【考點(diǎn)】質(zhì)量守恒定律及其應(yīng)用;有關(guān)化學(xué)式的計(jì)算和推斷.
【分析】解此題需根據(jù)質(zhì)量守恒定律,反應(yīng)前后原子種類和個數(shù)都不變,分別統(tǒng)計(jì)出反應(yīng)前后原子種類及個數(shù),比較分析就可以求出所求的物質(zhì)的化學(xué)式.
【解答】解:根據(jù)質(zhì)量守恒定律,反應(yīng)前后原子種類和個數(shù)都不變,由方程式知反應(yīng)物中含有的原子種類及原子個數(shù)為C,12;H,20;N,12;O,46;已知生成物中含有的原子種類及原子個數(shù)為C,12;H,20;O,34;比較分析可知12A中含有12個氮原子和12個氧原子,故A的化學(xué)式為NO.
故選A.
【點(diǎn)評】此題主要考查學(xué)生對質(zhì)量守恒定律的實(shí)際運(yùn)用,只有掌握了這一知識的內(nèi)涵,才能自由駕御,正確解答.
4.下列化常用語中,正確的是( )
A.兩個氧分子﹣O2
B.氫氧化鐵的化學(xué)式﹣Fe(OH)3
C.CO2中氧元素的化合價(jià)為+2價(jià)
D.水通電得到氧氣的化學(xué)方程式是2H2O=O2↑+2H2↑
【考點(diǎn)】化學(xué)符號及其周圍數(shù)字的意義;化學(xué)式的書寫及意義;有關(guān)元素化合價(jià)的計(jì)算;書寫化學(xué)方程式.
【分析】A、根據(jù)分子的表示方法:正確書寫物質(zhì)的化學(xué)式,表示多個該分子,就在其化學(xué)式前加上相應(yīng)的數(shù)字,進(jìn)行解答;
B、根據(jù)鐵元素化合價(jià)為+3,氫氧根的化合價(jià)為﹣1,利用十字交叉法寫出化學(xué)式;
C、根據(jù)元素化合價(jià)的表示方法:確定出化合物中所要標(biāo)出的元素的化合價(jià),然后在其化學(xué)式該元素的上方用正負(fù)號和數(shù)字表示,正負(fù)號在前,數(shù)字在后,進(jìn)行解答;
D、根據(jù)書寫化學(xué)方程式的要求:寫配注等,進(jìn)行判斷.
【解答】解:A、根據(jù)分子的表示方法:正確書寫物質(zhì)的化學(xué)式,表示多個該分子,就在其化學(xué)式前加上相應(yīng)的數(shù)字,兩個氧分子應(yīng)表示為:2O2;故A錯誤;
B、根據(jù)鐵元素化合價(jià)為+3,氫氧根的化合價(jià)為﹣1,利用十字交叉法寫出化學(xué)式為:Fe(OH)3;故B正確;
C、根據(jù)元素化合價(jià)的表示方法:確定出化合物中所要標(biāo)出的元素的化合價(jià),然后在其化學(xué)式該元素的上方用正負(fù)號和數(shù)字表示,正負(fù)號在前,數(shù)字在后,CO2中氧元素的化合價(jià)應(yīng)表示為:C![]() 2;故C錯誤;
2;故C錯誤;
D、根據(jù)書寫化學(xué)方程式的要求:寫配注等,可知水通電得到氧氣的化學(xué)方程式為:2H2O![]() O2↑+2H2↑;故D錯誤;???
O2↑+2H2↑;故D錯誤;???
故選B.
【點(diǎn)評】本題考查了學(xué)生對化學(xué)用語的書寫和理解能力,及化學(xué)方程式的正確書寫.
5.實(shí)驗(yàn)室用草酸(H2C2O4)制取CO的化學(xué)方程式為H2C2O4![]() CO↑+X+CO2↑其中X的化學(xué)式為( )
CO↑+X+CO2↑其中X的化學(xué)式為( )
A.H2O2????????????? B.H2O????????????? C.CH4????????????? D.H2
【考點(diǎn)】有關(guān)化學(xué)式的計(jì)算和推斷;質(zhì)量守恒定律及其應(yīng)用.
【分析】根據(jù)化學(xué)方程式為H2C2O4![]() CO↑+X+CO2↑利用質(zhì)量守恒定律來推斷物質(zhì)X的化學(xué)式.
CO↑+X+CO2↑利用質(zhì)量守恒定律來推斷物質(zhì)X的化學(xué)式.
【解答】解:由化學(xué)方程式為H2C2O4![]() CO↑+X+CO2↑
CO↑+X+CO2↑
根據(jù)質(zhì)量守恒定律可知,在反應(yīng)前后的原子個數(shù)相等,
C原子個數(shù)前后相等,而H、O原子個數(shù)還不相等,
反應(yīng)前共2個H原子,則生成物X中含有2個H原子,
反應(yīng)前共4個O原子,反應(yīng)后現(xiàn)有3個O原子,則X中應(yīng)含有1個O原子,
則X的化學(xué)式為H2O,
故選B.
【點(diǎn)評】本題考查化學(xué)式的確定,學(xué)生應(yīng)能利用習(xí)題中的化學(xué)方程式和質(zhì)量守恒定律中的元素守恒、原子守恒來推斷物質(zhì)的化學(xué)式,注意守恒方法在解題中的應(yīng)用.
6.(眉山市中考化學(xué))某有機(jī)物R在足量氧氣中完全燃燒后的化學(xué)方程式如下:2R+13O2![]() 8CO2+10H2O.根據(jù)質(zhì)量守定律,R的化學(xué)式為( )
8CO2+10H2O.根據(jù)質(zhì)量守定律,R的化學(xué)式為( )
A.C4H10????????????? B.CH4????????????? C.CH4O????????????? D.C2H4O2
【考點(diǎn)】質(zhì)量守恒定律及其應(yīng)用.
【分析】解此題需根據(jù)質(zhì)量守恒定律,反應(yīng)前后原子種類和個數(shù)都不變,分別統(tǒng)計(jì)出反應(yīng)前后原子種類及個數(shù),比較分析就可以求出所的物質(zhì)的化學(xué)式.
【解答】解:根據(jù)質(zhì)量守恒定律,反應(yīng)前后原子種類和個數(shù)都不變,由方程式知生成物中含有的原子種類及原子個數(shù)為C,8;H,20;O,26;已知反應(yīng)物中含有的原子種類及原子個數(shù)為O,26;比較分析可知R中含有C和H元素,其原子個數(shù)分別為4和10,故R的化學(xué)式為C4H10
故選A.
【點(diǎn)評】此題主要考查學(xué)生對質(zhì)量守恒定律的實(shí)際運(yùn)用,只有掌握了這一知識的內(nèi)涵,才能自由駕御,正確解答.
7.如圖是用來表示物質(zhì)間發(fā)生化學(xué)變化的模型示意圖,圖中“![]() ”、“
”、“![]() ”分別表示兩種不同元素的原子.能用該示意圖表示的反應(yīng)是( )
”分別表示兩種不同元素的原子.能用該示意圖表示的反應(yīng)是( )
![]()
A.2H2+O2![]() 2H2O????????????? B.2H2O
2H2O????????????? B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2CO+O2![]() 2CO2????????????? D.H2+Cl2
2CO2????????????? D.H2+Cl2![]() 2HCl
2HCl
【考點(diǎn)】微粒觀點(diǎn)及模型圖的應(yīng)用;分子、原子、離子、元素與物質(zhì)之間的關(guān)系.
【分析】化學(xué)變化的模型示意圖表示:2個不同種原子構(gòu)成的化合物分子與1個同種原子構(gòu)成的單質(zhì)分子發(fā)生反應(yīng),反應(yīng)生成2個由不同種原子構(gòu)成的化合物分子;因此該反應(yīng)為兩種物質(zhì)生成一種物質(zhì)的化合反應(yīng);
根據(jù)該反應(yīng)中反應(yīng)物的組成特點(diǎn)及反應(yīng)的基本類型,可判斷所給四個反應(yīng)中與圖示反應(yīng)相符的一個反應(yīng).
【解答】解:由變化的模型示意圖,該反應(yīng)為兩種物質(zhì)(一種化合物與一種單質(zhì))發(fā)生反應(yīng)生成一種化合物的化合反應(yīng);而B反應(yīng)為一種物質(zhì)生成兩種物質(zhì)的分解反應(yīng),故反應(yīng)B與圖示反應(yīng)不符;反應(yīng)A、D均為單質(zhì)與單質(zhì)間發(fā)生的化合反應(yīng),與圖示反應(yīng)不符;只有反應(yīng)C的反應(yīng)物為化合物與單質(zhì)發(fā)生的化合反應(yīng)與圖示反應(yīng)相符;
故選C.
【點(diǎn)評】構(gòu)成相同的分子為同種物質(zhì)的分子,同種原子構(gòu)成的分子為單質(zhì)分子,不同種原子構(gòu)成的分子為化合物分子.
8.小明從化學(xué)方程式4P+5O2![]() 2P2O5中總結(jié)的信息有:①參加反應(yīng)的物質(zhì)是磷和氧氣②反應(yīng)條件是點(diǎn)燃③反應(yīng)前后分子的總數(shù)不變④反應(yīng)前后元素的種類不變.其中正確的是( )
2P2O5中總結(jié)的信息有:①參加反應(yīng)的物質(zhì)是磷和氧氣②反應(yīng)條件是點(diǎn)燃③反應(yīng)前后分子的總數(shù)不變④反應(yīng)前后元素的種類不變.其中正確的是( )
A.①②③????????????? B.①②④????????????? C.①③④????????????? D.②③④
【考點(diǎn)】化學(xué)方程式的概念、讀法和含義.
【分析】化學(xué)方程式的含義有:反應(yīng)物和生成物的種類;反應(yīng)的條件;反應(yīng)物和生成物的微觀粒子個數(shù)比;反應(yīng)物和生成物的質(zhì)量比等.
【解答】解:由化學(xué)方程式4P+5O2![]() 2P2O5可知,參加反應(yīng)的物質(zhì)是磷和氧氣,反應(yīng)條件是點(diǎn)燃,反應(yīng)前后元素的種類不變.
2P2O5可知,參加反應(yīng)的物質(zhì)是磷和氧氣,反應(yīng)條件是點(diǎn)燃,反應(yīng)前后元素的種類不變.
故選B.
【點(diǎn)評】解答本題的關(guān)鍵是要充分理解化學(xué)方程式的含義,只有這樣才能對化學(xué)方程式表示的意義做出正確的判斷.
9.在一只密閉容器內(nèi)有四種物質(zhì),在一定條件下充分反應(yīng),測得反應(yīng)前后各物質(zhì)的質(zhì)量如下表:
物質(zhì) | X | Y | Z | Q |
反應(yīng)前質(zhì)量/g | 8 | 2 | 40 | 5 |
反應(yīng)后質(zhì)量/g | 待測 | 24 | 8 | 23 |
下列說法正確的是( )
A.該反應(yīng)一定是置換反應(yīng)
B.Y、Q的相對分子質(zhì)量比一定為11:9
C.參加反應(yīng)的X、Z的質(zhì)量比為1:4
D.反應(yīng)后X的質(zhì)量為16
【考點(diǎn)】質(zhì)量守恒定律及其應(yīng)用;反應(yīng)類型的判定.
【分析】此題是借助質(zhì)量守恒定律對反應(yīng)物生成物先做出判斷,再利用質(zhì)量關(guān)系進(jìn)行求解,反應(yīng)中反應(yīng)物質(zhì)量會減少,生成物質(zhì)量會增加,從而判斷生成物與反應(yīng)物,即可判斷反應(yīng)的類型,且反應(yīng)物與生成物質(zhì)量相等可求出待測的質(zhì)量,據(jù)此回答問題即可.
【解答】解:根據(jù)質(zhì)量守恒定律可知,設(shè)待測質(zhì)量為a,反應(yīng)前各物質(zhì)的質(zhì)量總和=反應(yīng)后生成各物質(zhì)的質(zhì)量總和,則得:8g+2g+40g+5g=a+24g+8g+23g,解得a=0g.
XZ的質(zhì)量減少為反應(yīng)物,YQ的質(zhì)量增加為生成物.
A、置換反應(yīng)要求反應(yīng)物與生成物均是一種化合物和一種單質(zhì),而該反應(yīng)沒有說明四種物質(zhì)的種類,所以不能判斷該反應(yīng)一定是置換反應(yīng);
B、根據(jù)化學(xué)方程式的意義可知物質(zhì)之間的質(zhì)量比等于其相對分子質(zhì)量與其化學(xué)計(jì)量數(shù)乘積之比,該反應(yīng)沒有化學(xué)計(jì)量數(shù)的信息,所以無法得到Y(jié)、Q的相對分子質(zhì)量比一定為11:9的結(jié)論;
C、由以上分析可知參加反應(yīng)的X、Z的質(zhì)量分別為:8g:(40g﹣8g)=1:4,故C正確;
D、由分析可知反應(yīng)后X的質(zhì)量是0g,故D錯誤
故選C.
【點(diǎn)評】本題主要考查了學(xué)生根據(jù)圖表數(shù)據(jù)分析問題的能力,要學(xué)會去偽存真,挖掘出有效數(shù)據(jù).然后根據(jù)質(zhì)量守恒定律以及化學(xué)反應(yīng)中的質(zhì)量關(guān)系求解.
10.(眉山市中考化學(xué))“綠色奧運(yùn)”是2008年北京奧運(yùn)會的主題之一.為減輕大氣污染,在汽車尾氣排放口加裝“三效催化凈化器”,在不消耗其他物質(zhì)的情況下,可將尾氣中的CO、NO轉(zhuǎn)化為參與大氣循環(huán)的無毒混合氣體.試推測,該無毒混合氣體是( )
A.N2和CO2????????????? B.C02和N02????????????? C.C02和O2????????????? D.CO2和SO2
【考點(diǎn)】質(zhì)量守恒定律及其應(yīng)用;空氣的成分及各成分的體積分?jǐn)?shù).
【分析】根據(jù)質(zhì)量守恒定律,在化學(xué)反應(yīng)中,參加反應(yīng)前各物質(zhì)的質(zhì)量總和等于反應(yīng)后生成各物質(zhì)的質(zhì)量總和,可知反應(yīng)前后各元素種類不變.
【解答】解:由題意可知反應(yīng)物是CO和NO,即反應(yīng)物中含有C、N、O三種元素,生成物中也必須只能含有C、N、O三種元素,C中沒有N元素,D中沒有N元素多了S元素,B中雖然含有C、N、O三種元素,但二氧化氮是有毒氣體,故只有A答案正確.
故選A.
【點(diǎn)評】本題主要考查學(xué)生運(yùn)用質(zhì)量守恒定律進(jìn)行推斷的能力,要能靈活運(yùn)用質(zhì)量守恒定律解決實(shí)際問題.
11.某化合物X在一定條件下有如下反應(yīng):X+6O2![]() 6CO2+6H2O.下列說法正確的( )
6CO2+6H2O.下列說法正確的( )
A.X由碳、氫兩種元素組成
B.X中碳、氫兩種元素的質(zhì)量比為1:2
C.X的相對分子質(zhì)量是174
D.X中碳元素的質(zhì)量分?jǐn)?shù)為40%
【考點(diǎn)】有關(guān)化學(xué)式的計(jì)算和推斷;物質(zhì)的元素組成;相對分子質(zhì)量的概念及其計(jì)算;元素質(zhì)量比的計(jì)算;元素的質(zhì)量分?jǐn)?shù)計(jì)算;質(zhì)量守恒定律及其應(yīng)用.
【分析】由題意,知反應(yīng)的化學(xué)方程式為X+6O2![]() 6CO2+6H2O,根據(jù)質(zhì)量守恒定律:①宏觀意義:反應(yīng)物和生成物的總質(zhì)量不變;元素種類、質(zhì)量不變;②微觀意義:原子種類不變;原子數(shù)目不變; 原子質(zhì)量不變;故可推測X的化學(xué)式.
6CO2+6H2O,根據(jù)質(zhì)量守恒定律:①宏觀意義:反應(yīng)物和生成物的總質(zhì)量不變;元素種類、質(zhì)量不變;②微觀意義:原子種類不變;原子數(shù)目不變; 原子質(zhì)量不變;故可推測X的化學(xué)式.
【解答】解:由題意,知反應(yīng)的化學(xué)方程式為X+6O2![]() 6CO2+6H2O,根據(jù)質(zhì)量守恒定律的意義,則X含有6個碳原子、12個氫原子、6個氧原子,故X的化學(xué)式為C6H12O6,則:
6CO2+6H2O,根據(jù)質(zhì)量守恒定律的意義,則X含有6個碳原子、12個氫原子、6個氧原子,故X的化學(xué)式為C6H12O6,則:
A、X由碳、氫兩種元素組成,說法錯誤,應(yīng)由碳、氫、氧三種元素組成,故A錯誤;
B、X中碳、氫兩種元素的質(zhì)量比為1:2,說法錯誤,正確的質(zhì)量比為(12×6):(1×12)=6:1,故B錯誤;
C、X的相對分子質(zhì)量是12×6+1×12+16×6=180,故C錯誤;
D、X中碳元素的質(zhì)量分?jǐn)?shù)為:![]() ×100%=40%,故D正確.
×100%=40%,故D正確.
故選D
【點(diǎn)評】掌握有關(guān)化學(xué)式的計(jì)算和推斷方法;掌握質(zhì)量守恒定律的內(nèi)容及其應(yīng)用;掌握相對分子質(zhì)量的計(jì)算、元素質(zhì)量比的計(jì)算、元素質(zhì)量分?jǐn)?shù)的計(jì)算的方法.
12.亞硝酸鈉(NaNO2)外觀與食鹽很相似,有咸味,誤食易中毒.區(qū)別它們的一種方法是:隔絕空氣加熱.沒有明顯變化的是食鹽.能分解放出有刺激性氣味氣體的是亞硝酸鈉.此氣體可能是( )
A.SO2????????????? B.NO2????????????? C.N2????????????? D.NH3
【考點(diǎn)】質(zhì)量守恒定律及其應(yīng)用.
【分析】因?yàn)閬喯跛徕c分解放出的有刺激性氣味氣體,所以該氣體的元素組成必須不能超出亞硝酸鈉中的元素組成,還要注意該氣體有刺激性氣味.
【解答】解:A、SO2中含有硫元素,而亞硝酸鈉中不含有硫元素,所以A是不可能的;
B、NO2中的兩種元素在亞硝酸鈉中都有,并且該氣體也是有刺激性氣味的,所以B是正確的.
C、N2是無色無味的氣體,所以C是不可能的;
D、NH3中含有氫元素,而亞硝酸鈉中沒有氫元素,D也是錯誤的.
故選B.
【點(diǎn)評】由于該反應(yīng)是分解反應(yīng),氣體中所含的元素必須在亞硝酸鈉中能找到,依據(jù)是反應(yīng)前后元素種類不變.
13.在一個密閉容器中,有甲、乙、丙、丁四種物質(zhì)在一定條件下充分反應(yīng),測得反應(yīng)前后各物質(zhì)質(zhì)量如下表,則該密閉容器中發(fā)生的化學(xué)反應(yīng)類型為( )
物質(zhì) | 甲 | 乙 | 丙 | 丁 |
反應(yīng)前質(zhì)量/g | 4 | 2 | 58 | 5 |
反應(yīng)后質(zhì)量/g | 待測 | 27 | 0 | 19 |
A.分解反應(yīng)????????????? B.化合反應(yīng)????????????? C.置換反應(yīng)????????????? D.復(fù)分解反應(yīng)
【考點(diǎn)】質(zhì)量守恒定律及其應(yīng)用;反應(yīng)類型的判定.
【分析】在化學(xué)反應(yīng)后質(zhì)量增加的是生成物,質(zhì)量減少的是反應(yīng)物.
【解答】解:
反應(yīng)后丙物質(zhì)減少了58g,是反應(yīng)物;
乙物質(zhì)增加了25g,是生成物;
丁物質(zhì)增加了14g,是生成物;
根據(jù)質(zhì)量守恒定律可知,甲物質(zhì)是生成物,生成甲的質(zhì)量是58g﹣25g﹣14g=19g.
由分析可知,丙是反應(yīng)物,甲、乙、丁是生成物,屬于分解反應(yīng).
故選A.
【點(diǎn)評】在化學(xué)反應(yīng)中遵循質(zhì)量守恒定律,參加反應(yīng)的物質(zhì)的質(zhì)量等于反應(yīng)后生成的物質(zhì)的質(zhì)量.
14.下列觀點(diǎn)中正確的是( )
A.通過化學(xué)變化可以改變原子的種類和個數(shù)
B.改變物質(zhì)的性質(zhì)一定要通過化學(xué)變化
C.在化學(xué)變化中原子中的電子數(shù)不會發(fā)生變化
D.在化學(xué)變化中都伴隨著能量的變化
【考點(diǎn)】化學(xué)反應(yīng)的實(shí)質(zhì);物質(zhì)發(fā)生化學(xué)變化時(shí)的能量變化.
【分析】化學(xué)變化中原子的種類和個數(shù)不變,物質(zhì)的性質(zhì)包括物理性質(zhì)和化學(xué)性質(zhì),改變性質(zhì)不一定發(fā)生化學(xué)變化,在化學(xué)變化中原子中的電子要發(fā)生轉(zhuǎn)移,化學(xué)變化的過程都伴隨著能量的變化.
【解答】解:A、化學(xué)變化中原子的種類和個數(shù)不變,故A錯誤;
B、物質(zhì)的性質(zhì)包括物理性質(zhì)和化學(xué)性質(zhì),改變性質(zhì)不一定是化學(xué)性質(zhì),因此不一定通過化學(xué)變化,故B錯誤;
C、在化學(xué)變化中原子中的電子要發(fā)生轉(zhuǎn)移,因此電子數(shù)會發(fā)生變化,故C錯誤;
D、化學(xué)變化的過程都伴隨著能量的變化,故D正確,
故選D.
【點(diǎn)評】本題考查了化學(xué)變化的有關(guān)說法,完成此題,可以依據(jù)已有的知識進(jìn)行.
二、填空
15.(眉山市中考化學(xué))為了將汽油發(fā)動機(jī)尾氣中的NO轉(zhuǎn)化為N2,在某催化劑作用下用NH3與NO反應(yīng),其化學(xué)方程式為:4NH3+6NO![]() 5N2+6H2O;在通常狀況下,依據(jù)左式前后順序,反應(yīng)物與生成物中氣體的化學(xué)計(jì)量數(shù)之比= ν(NH3):ν(NO):ν(N2)=4:6:5 .
5N2+6H2O;在通常狀況下,依據(jù)左式前后順序,反應(yīng)物與生成物中氣體的化學(xué)計(jì)量數(shù)之比= ν(NH3):ν(NO):ν(N2)=4:6:5 .
【考點(diǎn)】化學(xué)方程式的概念、讀法和含義.
【分析】化學(xué)方程式配平后前面的數(shù)字即為化學(xué)計(jì)量數(shù),另外題干要求在通常狀況下,寫出各氣體的化學(xué)計(jì)量數(shù)之比,而水通常情況下是液態(tài).
【解答】解:化學(xué)方程式各物質(zhì)前面的配平數(shù)字即為化學(xué)計(jì)量數(shù),又因?yàn)橥ǔG闆r下,水是液態(tài),所以氣體為NH3、NO、N2,化學(xué)計(jì)量數(shù)之比為ν(NH3):ν(NO):ν(N2)=4:6:5.
故填:ν(NH3):ν(NO):ν(N2)=4:6:5
【點(diǎn)評】本題主要考查化學(xué)計(jì)量數(shù)的理解,屬基礎(chǔ)知識考查.
16.完成下列反應(yīng)的化學(xué)方程式,在括號內(nèi)注明反應(yīng)類型(選填“化合”、“分解”、“置換”
或“復(fù)分解”)或回答問題.
(1)實(shí)驗(yàn)室加熱高錳酸鉀制氧氣的反應(yīng): 2KMnO4![]() K2MnO4+MnO2+O2↑ 、 分解 .
K2MnO4+MnO2+O2↑ 、 分解 .
(2)實(shí)驗(yàn)室用鋅粒和稀硫酸制氫氣的反應(yīng): Zn+H2SO4═ZnSO4+H2↑ 、 置換 .
(3)生石灰與水生成熟石灰的反應(yīng): CaO+H2O═Ca(OH)2 ;此反應(yīng)過程中 放出 (選填“吸熱”或“放出”)熱量.
(4)用澄清石灰水檢驗(yàn)二氧化碳的反應(yīng): CO2+Ca(OH)2═CaCO3↓+H2O ;
問:為何一般可用澄清石灰水檢驗(yàn)少量二氧化碳,卻用氫氧化鈉溶液吸收較多二氧化碳?
答: 雖然氫氧化鈣微溶,但其溶液遇少量CO2即渾濁;因氫氧化鈉易溶,故其濃溶液可吸收較多CO2 .
【考點(diǎn)】碳酸鈣、生石灰、熟石灰之間的轉(zhuǎn)化;實(shí)驗(yàn)室制取氧氣的反應(yīng)原理;氫氣的制取和檢驗(yàn);反應(yīng)類型的判定;書寫化學(xué)方程式.
【分析】高錳酸鉀能分解生成氧氣,鋅和稀硫酸能發(fā)生置換反應(yīng)生成氫氣,氧化鈣與水反應(yīng)放熱,二氧化碳能使澄清石灰水變渾濁,常用來檢驗(yàn)二氧化碳的存在.
【解答】解:(1)高錳酸鉀受熱能分解生成錳酸鉀、二氧化錳和氧氣,所以本題答案為:2KMnO4![]() K2MnO4+MnO2+O2↑,分解;
K2MnO4+MnO2+O2↑,分解;
(2)鋅能與硫酸反應(yīng)生成硫酸鋅和氫氣,屬于置換反應(yīng),所以本題答案為:Zn+H2SO4═ZnSO4+H2↑,置換;
(3)氧化鈣與水反應(yīng)生成氫氧化鈣同時(shí)放出熱量,所以本題答案為:CaO+H2O═Ca(OH)2,放出;
(4)二氧化碳能與氫氧化鈣反應(yīng)生成碳酸鈣沉淀和水,氫氧化鈣微溶于水,能與水反應(yīng)生成碳酸鈣沉淀,現(xiàn)象明顯,用來檢驗(yàn)二氧化碳的存在,而氫氧化鈉易溶于水,能與較多的二氧化碳反應(yīng),常用來吸水二氧化碳,所以本題答案為:CO2+Ca(OH)2═CaCO3↓+H2O,雖然氫氧化鈣微溶,但其溶液遇少量CO2即渾濁;因氫氧化鈉易溶,故其濃溶液可吸收較多CO2.
【點(diǎn)評】本題考查了常見物質(zhì)的性質(zhì)以及相互間的反應(yīng),完成此題,可以依據(jù)已有的知識進(jìn)行.
17.對知識的比較和歸納是學(xué)習(xí)科學(xué)的重要方法之一.現(xiàn)有以下3個反應(yīng)的化學(xué)方程式:
①CuSO4+Fe=Cu+FeSO4
②CuO+H2![]() Cu+H2O
Cu+H2O
③SiO2+2C![]() Si+2CO↑
Si+2CO↑
(1)比較反應(yīng)物和生成物的特點(diǎn),可歸納出這3個反應(yīng)的基本反應(yīng)類型都屬于 置換反應(yīng) .
(2)從反應(yīng)條件角度分析,這3個反應(yīng)應(yīng)用于生產(chǎn)最早的是(填編號) ① .
【考點(diǎn)】反應(yīng)類型的判定.
【分析】(1)根據(jù)置換反應(yīng)的定義判斷.
(2)根據(jù)化學(xué)的發(fā)展史判斷并回答.
【解答】解:(1)置換反應(yīng)是指一種單質(zhì)與一種化合物反應(yīng),生成另一種單質(zhì)和另外一種化合物的反應(yīng),以上三個反應(yīng)都符合置換反應(yīng)的定義.
(2)①CuSO4+Fe=Cu+FeSO4是濕法冶金的反應(yīng),在我國的西漢時(shí)期就已發(fā)現(xiàn),在《淮南萬畢術(shù)》一書中就有記載,是這3個反應(yīng)應(yīng)用于生產(chǎn)最早的.
故答案為:(1)置換反應(yīng);(2)①.
【點(diǎn)評】反應(yīng)類型是初中化學(xué)的基本概念之一,也是考查的重點(diǎn)和熱點(diǎn)之一,理解它們的概念,了解分類的依據(jù),掌握它們間區(qū)別和聯(lián)系是解決該類習(xí)題的關(guān)鍵.
18.自來水消毒過程中常會發(fā)生如下化學(xué)反應(yīng),其反應(yīng)的微觀過程可用如圖表示:
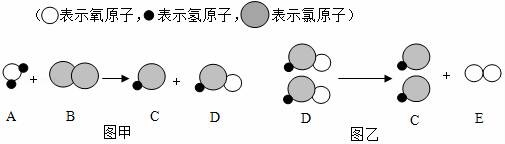
(1)圖乙所示反應(yīng)的基本反應(yīng)類型為 分解 反應(yīng);
(2)D物質(zhì)中氯元素的化合價(jià)為 +1 ;
(3)寫出圖甲所示反應(yīng)的化學(xué)方程式 H2O+Cl2=HCl+HClO .
【考點(diǎn)】微粒觀點(diǎn)及模型圖的應(yīng)用;有關(guān)元素化合價(jià)的計(jì)算;反應(yīng)類型的判定;書寫化學(xué)方程式.
【分析】自來水消毒通常用采用通入氯氣的方法,從圖示可以看出,發(fā)生的反應(yīng)正是氯氣與水的反應(yīng),生成的次氯酸再發(fā)生分解反應(yīng).由此可以推知每個模型表示的物質(zhì),然后寫出化學(xué)方程式,本題便迎刃而解.
【解答】解:(1)通過圖乙化學(xué)反應(yīng)的模型圖可以看出;反應(yīng)物是一種,生成物是兩種,屬于分解反應(yīng);
(2)通過分析,D物質(zhì)是次氯酸,化學(xué)式為HClO,其中氫為+1價(jià),氧為﹣2價(jià),氯元素的化合價(jià)就為+1;
(3)通過甲圖的微觀粒子、化學(xué)反應(yīng)的模型圖可以得出:反應(yīng)物是水和氯氣,生成物是鹽酸和次氯酸,各物質(zhì)的微觀個數(shù)關(guān)系是1:1:1:1,其反應(yīng)的方程式是:H2O+Cl2=HCl+HClO;
故答案為:(1)分解.
(2)+1;(3)H2O+Cl2=HCl+HClO.
【點(diǎn)評】解答本題要充分理解圖中提供的信息,只有這樣才能確定物質(zhì)的種類,也才能正確的判斷物質(zhì)的化學(xué)式和反應(yīng)類型及化合價(jià).
四、(眉山市中考化學(xué))計(jì)算題
19.工業(yè)上用電解氯化鎂方法生產(chǎn)金屬鎂:MgCl2![]() Mg+Cl2↑.現(xiàn)電解950Kg氯化鎂最多能生產(chǎn)多千克單質(zhì)鎂?同時(shí)能得到多少千克氯氣?
Mg+Cl2↑.現(xiàn)電解950Kg氯化鎂最多能生產(chǎn)多千克單質(zhì)鎂?同時(shí)能得到多少千克氯氣?
【考點(diǎn)】根據(jù)化學(xué)反應(yīng)方程式的計(jì)算.
【分析】由氯化鎂的質(zhì)量根據(jù)化學(xué)方程式可以計(jì)算出生成鎂和氯氣的質(zhì)量.
【解答】解:設(shè)生成鎂的質(zhì)量為x,生成氯氣的質(zhì)量為y.
MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
95??????? 24 7

孔乙己是貧困潦倒的知識分子。在書中,孔乙己是一個知識分子,滿口“之乎者也”,但是他很窮,還竊書,說過“讀書人的事,怎么能叫竊,”被人嘲笑,他...

自然界產(chǎn)生氧氣的化學(xué)方程式:光合作用的反應(yīng)式為6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反應(yīng)和暗反應(yīng)兩個過程。需要具備光...

有的高校沒有條件,只要學(xué)業(yè)水平成績都合格就可以,比如中國科學(xué)院大學(xué)。有的需要平常學(xué)習(xí)考試成績,比如北京外國語大學(xué)要求高三第一學(xué)期期末成績在全...

在四則運(yùn)算中,表示計(jì)算順序,在小括號之后、大括號之前;表示兩個整數(shù)的最小公倍數(shù);表示取未知數(shù)的整數(shù)部分;在函數(shù)中,表示函數(shù)的閉區(qū)間;在線性代...

濟(jì)南開設(shè)的最好的職高學(xué)校有:濟(jì)南方信集團(tuán)職業(yè)高中、濟(jì)南公共交通職業(yè)高中。濟(jì)南市公共交通職業(yè)高級中學(xué)是由濟(jì)南市公共交通總公司承辦,業(yè)務(wù)屬濟(jì)南市...

實(shí)然:是說事物實(shí)際上就是這樣的,但不同于現(xiàn)實(shí)性(現(xiàn)實(shí)性指其有合理性和客觀性);應(yīng)然:就是應(yīng)該是怎么樣的意思,比如說這件事,就應(yīng)該是那樣的結(jié)果...

地中海氣候一種夏季炎熱干燥、冬季溫和多雨,雨熱不同期的氣候類型。地中海氣候冬季受西風(fēng)帶控制,鋒面氣旋頻繁活動,氣候溫和,最冷月的氣溫在4-1...

堿石灰,又稱鈉石灰,堿石灰是白色或米黃色粉末,疏松多孔,是氧化鈣(CaO,大約75%),水(H?O,大約20%),氫氧化鈉(NaOH,大約3...